



A segurança e imunogenicidade da ButanVac, a nova vacina do Butantan contra a Covid-19 que será inteiramente produzida no Brasil, serão comprovadas por meio de um estudo de comparação de resposta imune dividido em três etapas e que envolverá cerca de 6 mil pessoas nas cidades de São Paulo e Ribeirão Preto.
"Este será um estudo diferente. Não é um estudo clássico de fase 1, 2 e 3, mas de comparabilidade de resposta imune. Com isso, você pode chegar aos resultados de eficácia da vacina", explicou o presidente do Instituto Butantan, Dimas Covas, nesta quarta (16) em coletiva de imprensa no Palácio dos Bandeirantes.
Conforme aprovação da Agência Nacional de Vigilância Sanitária (Anvisa), as fases 1 e 2 dos ensaios clínicos da ButanVac serão divididas nas etapas A, B e C. A etapa A vai envolver 418 voluntários com o objetivo de avaliar segurança e seleção de dose (dose de imunizante que será incorporada na vacina definitiva), e será realizada pela Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (USP) e pela Faculdade de Medicina da USP em São Paulo. Já as etapas B e C terão como objetivo avaliar a resposta imune e envolverão mais de 5 mil voluntários.
Na etapa A, o grupo de pessoas vacinadas será comparado a um grupo controle que receberá placebo. Nas etapas seguintes, acontece a comparação entre o desempenho da nova vacina do Butantan contra a Covid-19 e outras vacinas que estão em uso e já têm dados publicados, como a CoronaVac.
Farão parte do estudo pessoas não vacinadas e que não foram expostas ao vírus, pessoas vacinadas (independente do imunizante) e pessoas que tiveram Covid-19. Para ser voluntário, é preciso ter mais de 18 anos. “À medida que o estudo for progredindo, os critérios de seleção serão oportunamente divulgados”, explicou Dimas.
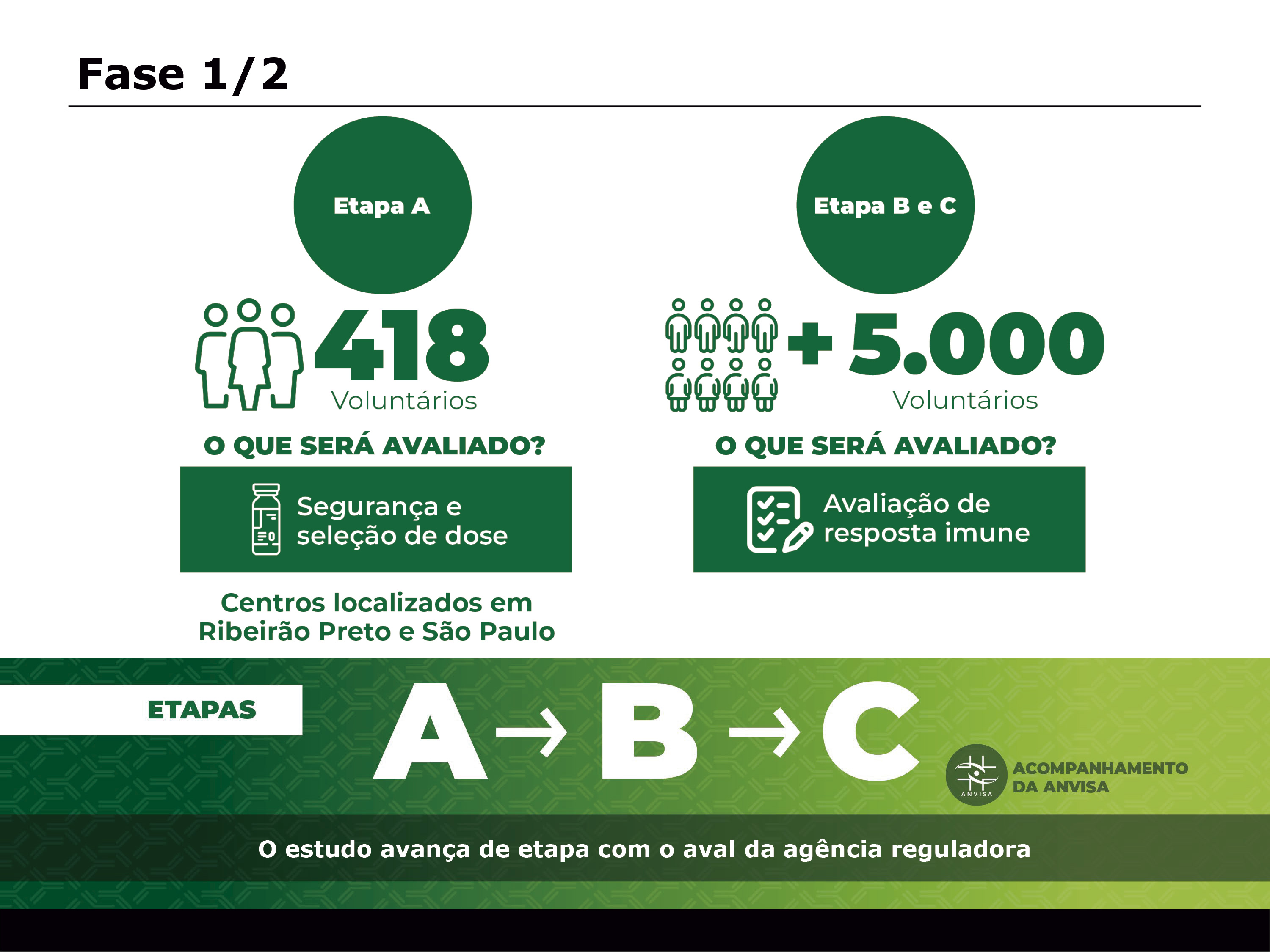
A previsão é que a pesquisa dure 17 semanas, mas o prazo pode ser alterado porque as etapas são progressivas, ou seja, só há avanço após a conclusão do estágio anterior e com base na análise dos dados obtidos. Todo o processo será acompanhado pela Anvisa e as conclusões finais serão encaminhadas à agência para solicitar a autorização de uso emergencial.
Além da eficácia geral da ButanVac, os ensaios clínicos vão avaliar seu desempenho diante das novas variantes do vírus SARS-CoV-2. Segundo Dimas Covas, serão estudadas pelo menos três composições diferentes em termos de variantes.
"A ButanVac é um desenvolvimento de um consórcio internacional. O Butantan é o maior produtor desse consórcio e já fabricou um grande quantitativo de vacinas. É a vacina versão 2.0, uma evolução em relação à primeira geração de vacinas, não só em relação à resposta imune, mas também da plataforma produtiva", afirmou o presidente do instituto.
Isso porque a vacina é produzida na mesma fábrica da vacina da gripe, utilizando como matéria-prima ovos embrionados de galinha, e essa tecnologia traz enormes vantagens: obtém-se um produto que pode estar disponível facilmente em todo o mundo, especialmente nos países em desenvolvimento, a um custo baixo.
Site da ButanVac
Além de explicar como vão funcionar os ensaios clínicos da ButanVac, Dimas Covas apresentou o site da vacina (butanvac.butantan.gov.br), que reúne informações sobre o imunizante, seu método de produção, histórico e perguntas e respostas, além de trazer orientação aos interessados em se tornarem voluntários dos estudos clínicos.
No site, é possível fazer um pré-cadastro manifestando esse interesse. Basta preencher o formulário fornecendo dados como nome, e-mail e telefone. Quem fizer o pré-cadastro vai receber informações sobre o início dos estudos e o que é preciso para se inscrever junto aos centros de pesquisa.
Como é de praxe nos ensaios clínicos, eles não são conduzidos pelo Butantan (a instituição que desenvolve o imunizante em teste), mas por instituições parceiras. Essa é uma medida que garante a idoneidade e a confiabilidade dos resultados. O Butantan não recruta voluntários para ensaios clínicos de nenhuma de suas vacinas.



