



Estudos clínicos são processos complexos e de extrema importância para a saúde pública. Sem o voluntariado em pesquisa, não haveria nenhuma vacina aprovada contra a Covid-19 até hoje – e muito mais vidas teriam sido perdidas. Estima-se que, em 2021, a vacinação contra o SARS-CoV-2 evitou 20 milhões de óbitos no mundo, segundo estudo britânico publicado na The Lancet Infectious Diseases. A segurança e a proteção do voluntário são garantidas por um Comitê de Ética e órgãos externos independentes, que analisam rigorosamente o protocolo do estudo antes de aprová-lo. Mesmo assim, durante a pandemia, participantes de pesquisas chegaram a ser chamados de “cobaias” porque, de acordo com movimentos antivacina, estariam testando produtos que não eram seguros.
A diretora médica do Butantan, Fernanda Boulos, esclarece que participar de estudos clínicos é seguro e que os voluntários jamais são submetidos a riscos significativos. “É importante que as pessoas entendam que fazer parte dessas pesquisas é contribuir para a ciência e para a saúde pública. O que elas estão fazendo pode trazer um benefício não só individual, mas coletivo. Sem voluntários, a gente não faz estudos e não produz vacinas e fármacos, e isso é fundamental”, afirma.
A disponibilização de imunizantes e terapias para doenças não depende apenas do trabalho dos cientistas, mas também de cada indivíduo que se voluntaria para fazer parte de um estudo clínico. Se hoje temos vacinas para poliomielite, gripe, sarampo e febre amarela, por exemplo, e medicamentos para tratar inúmeras enfermidades, é porque tecnologias foram desenvolvidas e testadas em células, em animais e, por fim, em pessoas que se voluntariaram.
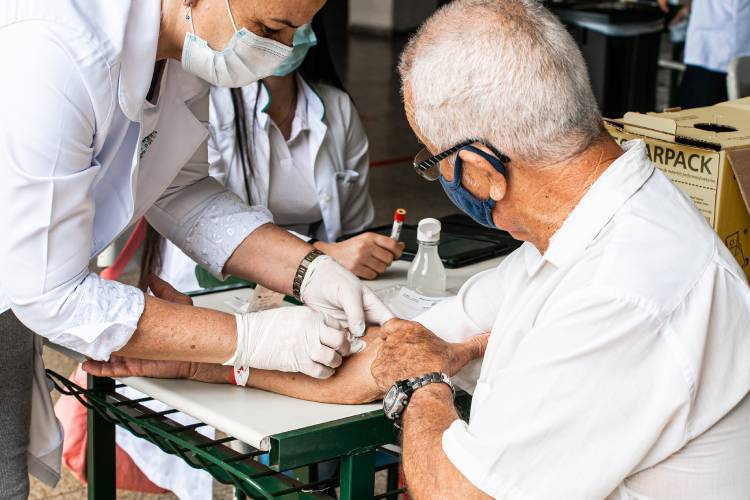
Mesmo com tamanha importância, obter voluntários para ensaios clínicos não é nada simples. Segundo Fernanda, a principal barreira está na falta de conhecimento sobre esse tema. No Brasil, a população tem pouco acesso à informação sobre ciência, o que acaba favorecendo a disseminação de mitos e a insegurança em participar de estudos.
Pesquisas clínicas com novas candidatas a vacinas, que devem ser feitas com um público saudável, são ainda mais desafiadoras, pois há uma menor tolerância a possíveis efeitos adversos, mesmo leves. “É diferente de um ensaio clínico de medicamento, que recruta pessoas que convivem com uma doença e querem se beneficiar do tratamento. Elas já estão acostumadas com a relação risco/benefício”, explica.
As dificuldades também esbarram na falta de apoio à pesquisa. Em 2020, os Estados Unidos investiram US$ 158,6 bilhões em ciência e tecnologia, enquanto no Brasil apenas R$ 17,2 bilhões (US$ 3,3 bilhões) foram destinados à área. Com verbas cada vez menores para pesquisa, jovens cientistas têm buscado oportunidades fora do país. De acordo com levantamento do Centro de Gestão de Estudos Estratégicos (CGEE), há atualmente de dois a três mil pesquisadores brasileiros no exterior.
Para Fernanda Boulos, além de investir mais em educação e ciência, criar uma cultura de participação em estudos clínicos no Brasil é essencial para o desenvolvimento tecnológico e científico do país. São necessárias campanhas de conscientização que expliquem detalhadamente o que são os ensaios clínicos, como eles podem ajudar a população, como é ser voluntário e quais são os seus direitos. “Nós precisamos fomentar essas ações para que a discussão que começou com a pandemia siga acontecendo com mais clareza, e sem informações erradas.”

Os direitos do voluntário
Participar de um estudo clínico não é ser cobaia porque se trata de uma ação voluntária que envolve a assinatura de um termo de consentimento. “O documento explica detalhadamente qual o produto a ser investigado, sua importância e as populações que ele poderá beneficiar, quais procedimentos serão feitos, os possíveis efeitos adversos e todos os direitos do participante”, afirma a diretora médica do Butantan.
Mesmo após assinar o termo, o voluntário é livre para encerrar a sua participação na pesquisa ou retirar o seu consentimento a qualquer momento, sem exceções. Os dados obtidos do indivíduo durante o período em que ele participou do estudo podem ou não ser usados, dependendo de sua autorização. Por exemplo, é possível sair do estudo, mas ainda permitir o uso dos dados, ou retirar totalmente o consentimento de uso de todas as informações, como se ele nunca tivesse participado da pesquisa.
“A palavra ‘cobaia’ não se aplica de jeito nenhum à pesquisa clínica, porque todo estudo em humanos é feito com consentimento e com mitigação de risco, justamente porque já aconteceram testes em animais”, explica Fernanda. A fase pré-clínica avalia a segurança e o potencial de eficácia da vacina ou tratamento em modelos animais. Depois, o produto segue para a fase 1 dos ensaios clínicos, em humanos, feita com uma população pequena e homogênea, para entender se há algum risco que não foi mapeado na etapa pré-clínica.
Na fase 2, os cientistas analisam a segurança, farmacocinética e farmacodinâmica do produto em uma população maior – ou seja, como aquele imunizante ou medicamento age no organismo e quais são os possíveis efeitos adversos. Essas etapas permitem estabelecer um perfil de segurança, e só então começa a fase 3, que recruta um grande número de participantes – podendo chegar a milhares. Vale ressaltar que, a cada fase concluída, os dados passam pela análise de agências reguladoras para que o estudo siga para a próxima etapa, se aprovado.
No caso da Covid-19, tecnologias para combater a Síndrome Respiratória Aguda Grave (SARS) vêm sendo estudadas desde 2003, quando houve o primeiro surto causado por um coronavírus, e serviram de base para desenvolver as novas vacinas contra o SARS-CoV-2. Além disso, a ciência hoje é muito mais avançada e a urgência da pandemia permitiu um investimento em pesquisas mais elevado e um maior interesse de voluntários, que queriam se proteger da doença, o que acelerou todo o processo.



