


-f5545b05cebeaef4.jpg)
Reportagem: Aline Tavares
Fotos: José Felipe Batista e Marília Ruberti
A partir de maio de 2025, pacientes brasileiros que obtém o anticorpo monoclonal Hyrimoz® (Adalimumabe) pelo Sistema Único de Saúde (SUS) receberão o medicamento em uma embalagem atualizada, com o nome “Instituto Butantan – Adalimumabe” e uma nova identidade visual. O fármaco será distribuído em sete estados: Amapá, Amazonas, Santa Catarina, Maranhão, Minas Gerais, Rio Grande do Sul e Rio Grande do Norte – demais localidades do país continuam contando com o medicamento fabricado por outras empresas.
A mudança é uma das etapas da Parceria para o Desenvolvimento Produtivo (PDP) firmada entre o Butantan e a farmacêutica suíça Sandoz, que está transferindo a tecnologia do seu produto para o Instituto. As instituições estabeleceram o acordo em 2021 com a intenção de ampliar o acesso a anticorpos monoclonais no Brasil – classe de medicamentos de alta tecnologia e precisão para tratar enfermidades complexas, como doenças autoimunes, doenças inflamatórias crônicas e câncer.
O Adalimumabe é indicado para o tratamento de enfermidades como artrite reumatoide, artrite psoriásica, espondilite anquilosante, artrite idiopática juvenil, psoríase, doença de Crohn, entre outras.
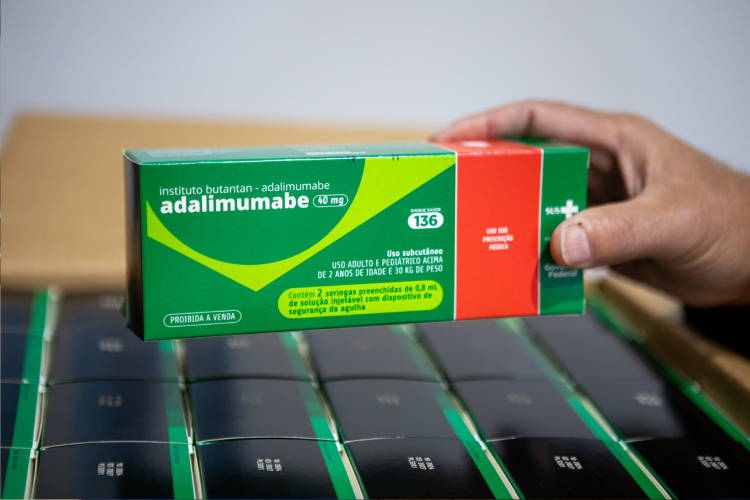
Embalagem atualizada com o nome Instituto Butantan - Adalimumabe (Foto: José Felipe Batista)
Durante o processo de substituição das embalagens, é possível que tanto a versão antiga como a nova sejam encontradas simultaneamente, devido ao remanescente dos estoques. Vale esclarecer, porém, que o remédio contido nas caixas é exatamente o mesmo, com a mesma qualidade, segurança e eficácia. No momento da retirada, o paciente receberá do profissional de saúde um folder com explicações sobre a alteração.
Outra novidade é que, a partir de agora, as eventuais dúvidas ou questionamentos sobre o Instituto Butantan – Adalimumabe deverão ser encaminhadas ao Serviço de Atendimento ao Cliente (SAC) do Butantan, disponível pelo telefone 0800 701 2850 (de segunda a sexta, das 8h às 17h), pelo WhatsApp (11) 99414-3504 ou pelo e-mail sac@butantan.gov.br.
Além disso, os pacientes continuam contando com a assistência do Programa Cuidar+ da Sandoz, que inclui suporte sobre onde encontrar o produto, embalagem térmica, aplicação monitorada e gratuita em clínicas (durante os primeiros 6 meses de tratamento), orientação de um profissional de saúde em domicílio sobre autoaplicação e exames de acompanhamento. O atendimento é feito pelo telefone 0800 770 1256.
Por que a escolha dos sete estados?
O anticorpo monoclonal Adalimumabe produzido pela Sandoz sob o nome comercial Hyrimoz®, aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) em 2020, é um biossimilar do medicamento referência Humira®, o Adalimumabe original, desenvolvido por uma farmacêutica norte-americana. Uma vez que a proteção intelectual do Humira® expirou, outras indústrias puderam desenvolver produtos biossimilares, ou seja, sua própria “versão” do Adalimumabe.
Assim como o Hyrimoz®, outros similares ao Adalimumabe foram registrados pela Anvisa nos últimos cinco anos. No SUS, por estratégia logística do Ministério da Saúde e de acordo com a disponibilidade de cada produto, cada versão do medicamento é encaminhada a estados diferentes, sendo que cada estado recebe sempre o mesmo produto. O objetivo é garantir que o tratamento chegue a todos os pacientes que precisam.

Fábrica de anticorpos monoclonais do Butantan (Foto: Marília Ruberti)
A segurança e as vantagens dos biossimilares
Diferente dos genéricos, que são sintetizados quimicamente e idênticos ao remédio original, os biossimilares são compostos por moléculas mais complexas, produzidas a partir de sistemas vivos – por isso, assim como os medicamentos biológicos de referência, podem sofrer variações mínimas durante a produção que não impactam na qualidade. Os biossimilares são altamente semelhantes aos biológicos de referência e passam por rigorosos testes de comparabilidade.
Mais de 150 biossimilares já foram registrados pelas agências reguladoras dos Estados Unidos e da Europa, e 51 foram autorizados no Brasil pela Anvisa. Um estudo publicado na revista Cancers, que analisou dados de farmacovigilância de anticorpos monoclonais biossimilares usados na Europa, registrados em um período de dois anos, mostrou que o perfil de segurança dos biossimilares é o mesmo dos produtos de referência.
Desde a década de 1980, os medicamentos biológicos têm revolucionado a terapia de doenças crônicas e câncer, mas o alto custo limita seu acesso. Com o desenvolvimento dos biossimilares, o valor do tratamento pode reduzir até 50%, de acordo com o relatório The U.S. Generic & Biosimilar Medicines Savings Report 2022, da Associação para Medicamentos Acessíveis dos Estados Unidos. O documento aponta uma economia de US$7 bilhões gerada pelos biossimilares.



